- 难溶电解质的溶解平衡及沉淀转化的本质
- 共53题
某温度下,Fe(OH)3(s)和Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
正确答案
解析
b、c两点的金属阳离子的浓度相等,设浓度都为x,c(OH-)c=10-9.6, c(OH-)b=10-12.7 ,则Ksp[Fe(OH)3]=x×(10-12.7)3,Ksp [Cu(OH)2] =x×(10-9.6)2,故Ksp[Fe(OH)3]<Ksp [Cu(OH)2];由a点变到b点,碱性增强,而NH4Cl溶于水后,溶液呈酸性,故B错误;只要温度一定,Kw就一定,C正确;溶度积曲线上的点表示溶液达到饱和,曲线左下方表示不饱和,右上方Q>K,表示沉淀要析出,故D正确。
知识点
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go
(4)根据下表数据,调节“滤液
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a,大理石粉 b,石灰乳 c,纯碱溶液 d,烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
正确答案
(1)增大反应物接触面积或增大反应速率或使反应更充分
(2)
(3)
(4)
(5)b或(b和d);d
(6)蒸发浓缩、冷却结晶
(7)
解析
(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使反应更加充分。
(2)漂白粉的成分中含有次氯酸根,调节酸碱度后,具有较强的氧化性,能使+2价的铁氧化成+3价,氢氧化亚铁变成氢氧化铁必须增加氢氧元素的量,可以推测出另一种反应物为水,清楚了反应物,一般可以顺利地配平。
(3)化学式量为89,组成元素是



(4)






(5)a大理石粉难溶于水、选择熟石灰和烧碱溶液可以使溶液的碱性增强,有利于镁离子完全沉淀。
(6)蒸发浓缩、冷却结晶能使晶体尽快地析出。
(7)综合计算(不展开)
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
本题综合考查化学实验以及元素化合物的相关知识。
A选项,铁粉过量应该生成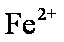
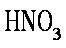
知识点
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
正确答案
解析
本题主要考察溶度积常数的概念和有关计算。对应化学式相似的AgCl和AgI来说Ksp越小Ag+浓度越小,即AgCl>AgI;假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,即x3=4.0×10-12,因为AgCl饱和溶液中Ag+的浓度为
知识点
溴酸银( AgBr03)溶解度随温度变化曲线如图所示,下列说法错误的是
正确答案
解析
略
知识点
扫码查看完整答案与解析












